Сотрудники факультета фундаментальной медицины МГУ имени М.В.Ломоносова описали молекулярные механизмы влияния посттрансляционных модификаций белков семейства каспаз на процесс их активации и протекание программируемой клеточной гибели — апоптоза. Результаты исследования опубликованы в журнале Trends in Cell Biology.
Организм всех известных живых существ постоянно требует очистки от «лишних» клеток, которые уже выполнили свою функцию или стали опасны в результате повреждений генетического материала, вызываемых, например, различными токсическими веществами, ультрафиолетовой радиацией и другими причинами. Самоуничтожение таких потенциально опасных клеток известно как процесс программируемой гибели клеток, один из видов которого — апоптоз. Он позволяет поддерживать тканевой гомеостаз, замещать старые клетки новыми. Известно, что в течение 70 лет жизни эпителий кишечника обновляется примерно 4000 раз, и если выполнившие свои функции клетки не уничтожаются, то за 70 лет длина кишечника может составить 32 километра. За те же 70 лет организм производит примерно 3 тонны клеток костного мозга.
«Нарушения в механизме запуска и протекания апоптоза приводят к самым нежелательным последствиям для организма. Так, избыточная клеточная смерть уничтожает нейроны, приводя наш мозг в состояние, при котором сначала теряется кратковременная память, а потом и долговременная, страдает крупная и мелкая моторика, развиваются психозы. Развитие болезни Альцгеймера, Паркинсона, бокового амиотрофического склероза, хореи Хантингтона в той или иной степени связано с повышенной апоптотической гибелью клеток. Кроме того, чрезмерная гибель может вызывать гематологические, иммунные, метаболические заболевания. Однако один из самых печальных примеров заболеваний, связанных с нарушениями апоптоза, характеризуется его недостаточностью. Клетка, получившая мутацию, в норме должна запустить процесс самоуничтожения, но слабый контроль и нарушения в апоптотических механизмах вызывают появление злокачественных образований», — говорит профессор Борис Животовский, руководитель лаборатории исследования механизмов апоптоза, в которой была выполнена работа.
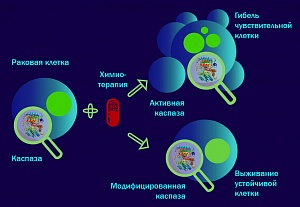
Запуск и протекание апоптотических процессов на молекулярном уровне обеспечивают специальные белки-ферменты — цистеиновые протеазы, или каспазы. В норме эти ферменты существуют в виде неактивной проформы и должны претерпеть ряд расщеплений для формирования активного тетрамера. Сигналом для запуска программы самоуничтожения клетки может стать огромное количество разнообразных стимулов: связывание определенных молекул с «рецепторами смерти» на поверхности клетки, повреждение ДНК, накопление неправильно свернутых белков, отсутствие питательных веществ, появление в клетке активных форм кислорода, нагревание. Все вышеуказанные факторы способствуют запуску серии последовательных реакций активации каспаз, или каспазному каскаду. Понимание деталей процессов регуляции каспаз тесно связано с возможностью рационально манипулировать апоптозом с целью получения терапевтических преимуществ. Вся цепочка реакций начинается с расщепления так называемых инициаторных каспаз, которые активируют эффекторные каспазы. Появление активных протеаз в клетке приводит к разрушению большинства клеточных структур, деградации ядра и распаду клетки на апоптотические тельца. Однако эта сложная система требует тщательного контроля, поскольку случайная активация каспаз может привести к печальным последствиям для клетки.
«Многие белки и секретируемые пептиды претерпевают различные структурные изменения в результате посттрансляционных модификаций (ПТМ), то есть после завершения их синтеза рибосомами. Посттрансляционные модификации заключаются в ковалентной модификации белков после завершения их синтеза рибосомами. Данный процесс играет ключевую роль в создании гетерогенности белков, в исключении идентичных белков, их деградации, тканеспецифичных механизмов действия и регуляции их активности. Благодаря ПТМ один белок может выполнять разные функции в клетке одного и того же организма. Таким образом, ПТМ создает дополнительный тонкий уровень регуляции функции белка, позволяющий более динамично реагировать на изменения, происходящие в клетке. Модификации происходят в эндоплазматическом ретикулуме и аппарате Гольджи. Например, специальные белки — киназы — переносят остатки фосфорной кислоты на определенный аминокислотный остаток в молекуле каспазы, что приводит к изменению структуры белка и ингибированию или, наоборот, активации его функций. Фосфорилирование каспаз, подробно проанализированных в опубликованной работе, приводит в подавляющем большинстве случаев к изменению конформации активного центра и, соответственно, ингибирует активность этих белков, подавляя тем самым процесс апоптоза», — поясняет Алексей Замараев, аспирант лаборатории и первый автор статьи.
«Посттрансляционные модификации играют ключевую роль в регуляции процесса активации и последующей активности каспаз, играя тем самым роль переключателей между программируемой гибелью клеток и их выживанием, что было четко продемонстрировано в материалах статьи», — говорит Евгения Прохорова, студентка МГУ, участница проекта.
«Один из важнейших выводов был сделан на основе биоинформатического анализа, который впервые показал высокую консервативность определенных сайтов фосфорилирования каспаз, расположенных вблизи активного центра этих протеаз, что дает ключ к пониманию общих принципов регуляции функционирования этих ферментов и их роли в регуляции апоптоза», — рассказывает Инна Лаврик, ведущий автор статьи, доктор химических наук, профессор, ведущий научный сотрудник лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ.
Для написания статьи ученые провели анализ более 250 источников, который выявил основные типы посттрансляционных модификаций с классификацией их на отдельные типы. Особое внимание уделялось тому, в каких условиях происходят такие модификации и к чему они приводят — к активации или, наоборот, к ингибированию действия каспаз. Помимо литературной работы, был проведен сравнительный биоинформатический анализ аминокислотных последовательностей каждой каспазы у позвоночных и беспозвоночных организмов. Кроме того, проведено сравнение участков посттрансляционных модификаций на основании третичной структуры белка. Такой анализ помог не только выявить консервативные аминокислотные остатки, которые подвергаются модификациям, но и предсказать новые. Более того, биоинформатический анализ позволил сделать заключение о высокой схожести некоторых сайтов фосфорилирования каспаз у эволюционно далеких организмов.
На основе полученных данных стало возможным предсказать новые, не описанные в литературе сайты модификации каспаз. Кроме того, полученные данные могут быть использованы для дизайна специфических ингибиторов либо активаторов, способных регулировать активность каспаз, для применения в лечении болезней, таких как нейродегенеративные и раковые заболевания, связанные с дисфункциями этих протеаз.
«На сегодняшний день существуют противораковые препараты, блокирующие активность определенных групп киназ (ферментов, осуществляющих посттрансляционное фосфорилирование), — так называемые ингибиторы тирозинкиназ (например, Afatinib, Bosutinib и т. д.). Данные препараты подавляют активность разных групп тирозинкиназ, стимулирующих рост злокачественных клеток. При этом запускается путь апоптоза, приводящий к активации каспаз. Кроме того, в настоящее время для лечения некоторых гематологических опухолей рекомендовано применение препарата Venetoclax (ABT-199), который подавляет функцию антиапоптотических белков и также вызывает активацию каспаз. Несколько фармацевтических фирм работает над созданием нового класса лекарств — ингибиторов киназ, которые будут способны негативно влиять на активность каспаз, подавляя тем самым апоптоз, что необходимо для лечения нейродегенеративных заболеваний», — заключает Галина Копеина, ведущий научный сотрудник лаборатории, участник проекта.