Сотрудники факультета фундаментальной медицины МГУ имени М.В.Ломоносова определили структуру пептидного комплекса, который образуется в мозге на ранних стадиях развития болезни Альцгеймера. Результаты исследования помогут в разработке соединений, способных останавливать развитие болезни. Результаты работы опубликованы в престижном журнале Angewandte Chemie (IF ~ 12).
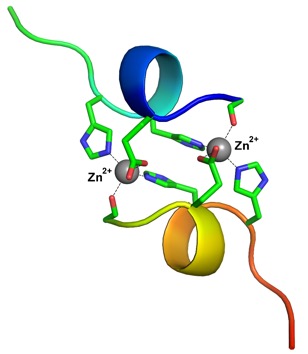
На ранних стадиях болезни Альцгеймера в мозге людей образуются скопления бета-амилоидного пептида. Научная группа из МГУ под руководством доктора химических наук Владимира Польшакова изучала молекулярные механизмы агрегации бета-амилоида у носителей тайваньской мутации, описала структуру образующихся комплексов и установила роль ионов цинка (Zn2+) в их образовании.
Бета-амилоид — это небольшой пептид, который выполняет важные физиологические функции, например, защищает мозг от потенциальных патогенов. После выполнения своих функций в норме пептид разрезается протеазами и утилизируется. Однако в некоторых случаях молекулы этого пептида начинают связываться друг с другом, образуя сложные комплексы, токсичные для нейронов. Процессы агрегации бета-амилоидного пептида в комплексы инициируют ионы переходных металлов.
В течение нескольких лет ученые МГУ в сотрудничестве с коллегами из Института молекулярной биологии РАН им. В.А. Энгельгардта исследовали молекулярный механизм цинк-зависимой агрегации бета-амилоидного пептида. В качестве модельного объекта они выбрали пептид с тайваньской мутацией. У носителей подобных мутаций болезнь Альцгеймера развивается в сравнительно молодом возрасте. Авторы обнаружили, что структура бета-амилоидных комплексов из мутантных пептидов оказывается более прочной и стабильной, чем у комплексов из нормальных пептидов. Ключевую роль в их образовании играют ионы цинка (Zn2+).
«К нашему удивлению, взаимодействие фрагмента этого пептида с ионами цинка привело к образованию стабильного комплекса, в котором две пептидные цепи оказались прочно скреплены двумя ионами цинка. Подобные биядерные структуры ранее не были описаны в мировой литературе, — комментирует Владимир Польшаков. — Важно отметить, что взаимодействие ионов металлов с бета-амилоидом обычно приводит к множеству разных конформаций пептидной цепи. Образующийся комплекс как бы “дышит”, переходя от одной конформации к другой. В случае же с продуктом тайваньской мутации наблюдалась единственная конформация, позволившая нам с высокой точностью определить ее структуру методами ядерного магнитного резонанса».
Полученные результаты помогут в разработке соединений, способных блокировать цинк-зависимую агрегацию бета-амилоида и, тем самым, останавливать развитие болезни Альцгеймера на ранних этапах. «На основании подтвержденного в данной работе молекулярного механизма инициирования патогенной агрегации бета-амилоида наши коллеги из Института молекулярной биологии уже запатентовали два соединения, способные блокировать процессы агрегации бета-амилоидного пептида. Изучение свойств этих соединений на животных моделях показало, что они в несколько раз уменьшают риск развития заболевания, соответствующего болезни Альцгеймера», — рассказал о перспективах исследования Владимир Польшаков.
Сотрудники лаборатории магнитной томографии и спектроскопии факультета фундаментальной медицины МГУ выполняли исследование в сотрудничестве с научной группой из Института молекулярной биологии РАН им. В.А. Энгельгардта (ИМБ РАН) под руководством академика Александра Макарова.
Работа проходила при поддержке Российского научного фонда (РНФ).
Фото: Структура комплекса фрагмента бета-амилоида - продукта тайваньской мутации, с ионами цинка. Источник: Владимир Польшаков