Ученые кафедры общей физики и волновых процессов физического факультета МГУ продемонстрировали комплексную технику термогенетических исследований индивидуальных нейронов в культурах клеток и животных с использованием инфракрасного лазерного излучения. О своем исследовании сотрудники факультета рассказали в статье, которая была опубликована в журнале Nature.
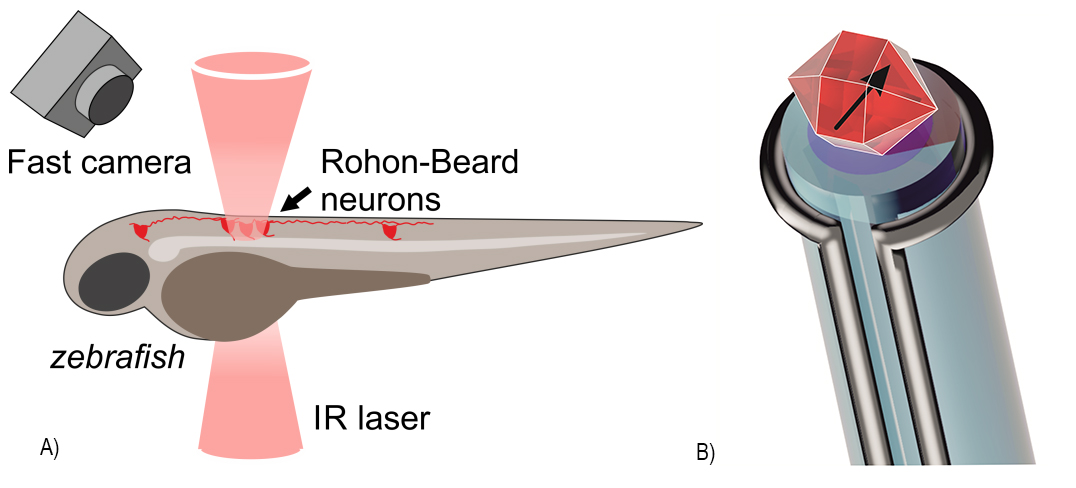 (A) Схема поведенческого эксперимента с рыбкой Danio rerio, включающего локальный нагрев трансфецированных Rohon-Beard нейронов инфракрасным лазерным излучением и запись реакции рыбки быстрой камерой. (B) Термометрическое устройство на основе гибридного оптического/СВЧ зонда с квантовым сенсором — микрочастица алмаза с дефектами азот-вакансия.
(A) Схема поведенческого эксперимента с рыбкой Danio rerio, включающего локальный нагрев трансфецированных Rohon-Beard нейронов инфракрасным лазерным излучением и запись реакции рыбки быстрой камерой. (B) Термометрическое устройство на основе гибридного оптического/СВЧ зонда с квантовым сенсором — микрочастица алмаза с дефектами азот-вакансия.
В работе демонстрируется методика быстрой, надежной и воспроизводимой адресной активации одиночных клеток в культуре и живом организме (in vitro и in vivo), экспрессирующих генетически встроенные термочувствительные каналы семейства TRPA1 с помощью перестраиваемого по длине волны инфракрасного лазерного излучения. В ходе работы были использованы чувствительные к теплу мембранные каналы caTRPA1 техасской гремучей змеи Crotalus atrox, активирующиеся при превышении пороговой температуры 28°С. Исследования показали, что такие термочувствительные каналы могут быть успешно экспрессированы нейронами рыбы и теплокровных животных.
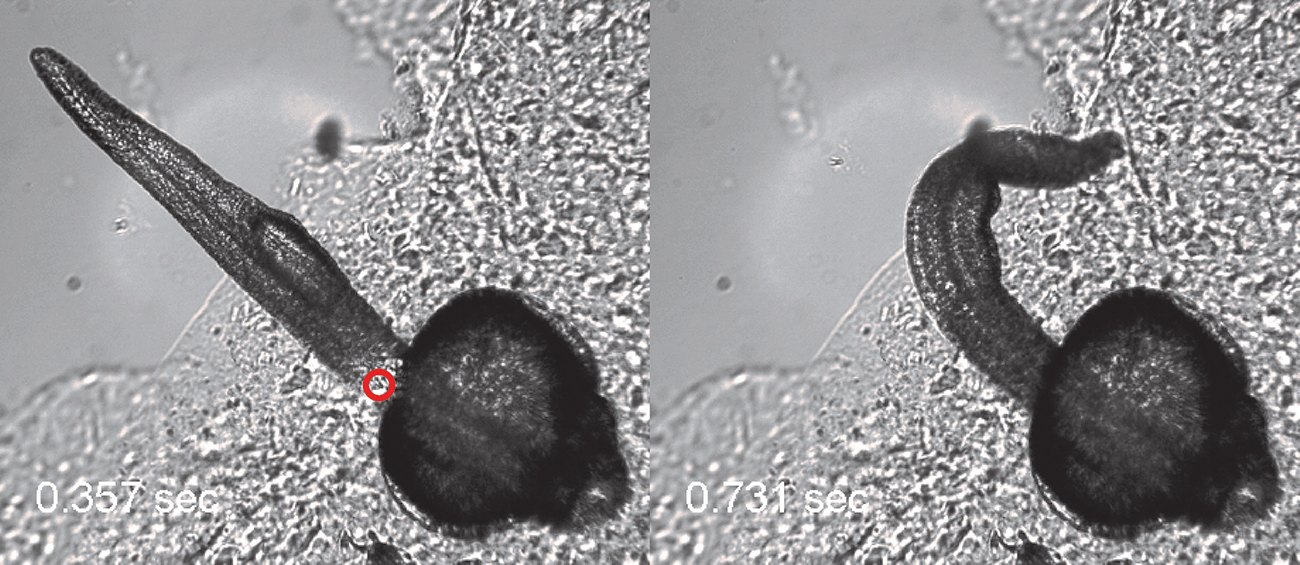 Покадровая развертка реакции Danio rerio на лазерный импульс длительностью 250 мс. (A) Локальный нагрев нейрона (лазерный пучок показан красной окружностью), (B) ответная реакция в виде удара хвостом.
Покадровая развертка реакции Danio rerio на лазерный импульс длительностью 250 мс. (A) Локальный нагрев нейрона (лазерный пучок показан красной окружностью), (B) ответная реакция в виде удара хвостом.
В работе была реализована серия поведенческих экспериментов на рыбке Danio rerio, в нейронах которой была осуществлена экспрессия термочувствительных каналов caTRPA1. Активация одного из группы этих нейронов (Rohon-Beard), расположенных на спинке рыбы, приводит к реакции убегания, проявляющаяся в резком ударе хвоста. Проведение флуоресцентной микроскопии позволило находить успешно трансфецированные нейроны, локальный нагрев которых осуществлялся импульсом инфракрасного излучения на длине волны 1342 нм длительностью 250 мс. Импульсный нагрев Rohon-Beard нейронов сопровождался ударом хвоста у трансфецированной рыбы, тогда как контрольная рыба (не обладающая каналами caTRPA1) не реагировала на лазерный нагрев.
Работа представляет результаты комплексного совместного исследования российских ученых из МГУ имени М.В.Ломоносова, Института биоорганической химии им (ИБХ РАН), Института высшей нервной деятельности и нейрофизиологии (ИВНД и НФ РАН).
Справочно:
Термогенетика — новая перспективная междисциплинарная область науки, суть которой заключается в принудительной и целенаправленной температурной активации физиологической деятельности клеток, в частности нейронов, за счет использования термочувствительных катионных каналов (TRP), генетически встроенных в мембраны этих клеток. До недавнего времени широкое применение этой техники было ограничено невысокой чувствительности известных термоканалов, а также низкого пространственно-временного разрешения методики их активации при стандартном нагреве среды или использовании химических агентов. Термогенетика обладает большими перспективами в области управления физиологической активностью клеток. Методы термогенетики не привязаны к спектрам поглощения хромофоров, лежащих в видимой области спектра, как это реализовано в оптогенетике. В связи с этим возникает возможность выбирать центральную длину волны лазерного излучения в окне прозрачности биологической ткани для осуществления стимуляции глубоких слоев. Используемые нами термочувствительные каналы caTRPA1 змеи не являются селективными по ионам, поэтому обладают проводимостью на несколько порядков превышающую проводимость популярных каналов семейства канал-родопсин ChR оптогенетики. Каналы caTRPA1 осуществляют в основном ток катионов кальция через мембрану, что позволяет управлять распространенной в живых организмах системой сигналинга, основанной на концентрации катионов кальция. На сегодняшний момент с этой задачей методы оптогенетики справляются плохо. На практике это может быть реализовано как малоинвазивная стимуляция тканей (нейронов, клеток сердца, клеток надпочечников и т.д.) для активации или ингибирования физиологического ответа клеток.
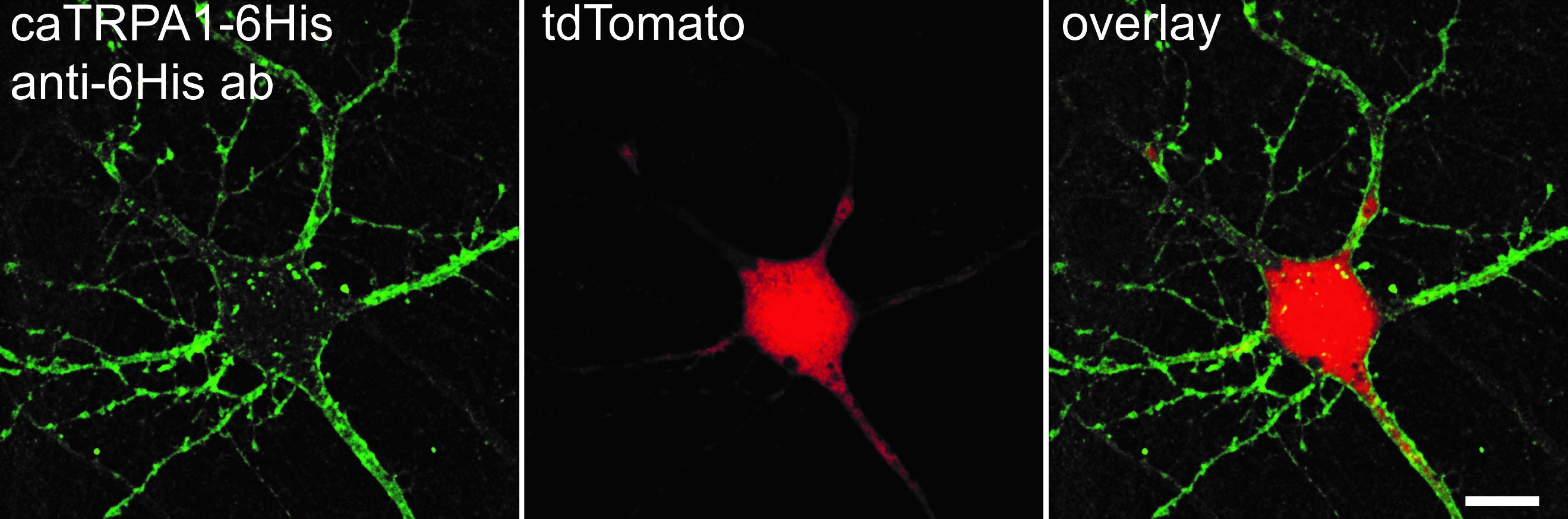
Фото: Двухцветная конфокальная микроскопия трансфецированного нейрона мыши, показывающая распределение термочувствительных каналов в мембране клетки (A) и наличие в теле клетки сенсора катионов кальция (B). (C) Совмещенные изображения